CONTROL DE LA ALCALINIDAD DEL AGUA DE RIEGO
3 participantes
Página 1 de 1.
 CONTROL DE LA ALCALINIDAD DEL AGUA DE RIEGO
CONTROL DE LA ALCALINIDAD DEL AGUA DE RIEGO
Hola de nuevo chic@s... Dado que surgió la idea de ir editando periódicamente un Boletín para el Club Bonsai Axarquía en el que ir exponiendo las últimas novedades, ideas, trabajos, etc. os traslado aquí el último trabajo publicado fruto de mi humilde labor documentalista con el único propósito, como siempre, de divulgación y con el fin de enriquecer lo ya expuesto con vuestras aportaciones y experiencias propias.
CONTROL DE LA ALCALINIDAD DEL AGUA DE RIEGO
La mayoría de nuestras aguas de red, la que sale del grifo, e incluso la de muchos pozos, arroyos y fuentes o manantiales naturales son de carácter BASE o alcalinas, contienen bicarbonatos disueltos y por lo tanto agregan nuestros sustratos material calcáreo. El riego con estas aguas puede limitar el buen desarrollo de nuestras plantas, causado por la elevación excesiva del pH del sustrato o del medio. La magnitud del efecto depende del contenido de bicarbonatos en el agua, la cantidad de agua aplicada, la capacidad buffer del suelo y de la sensibilidad de la planta referida.
Para comprender mejor las soluciones a aplicar en fuentes de agua con estos problemas, es necesario entender los conceptos de pH, alcalinidad y capacidad buffer o tampón.
El pH
La palabra pH es la abreviatura de "pondus Hydrogenium". Esto significa literalmente el peso del hidrógeno. El pH es un indicador del número de iones de hidrógeno. Tomó forma cuando se descubrió que el agua estaba formada por protones (H+) e iones hidroxilo (OH-).
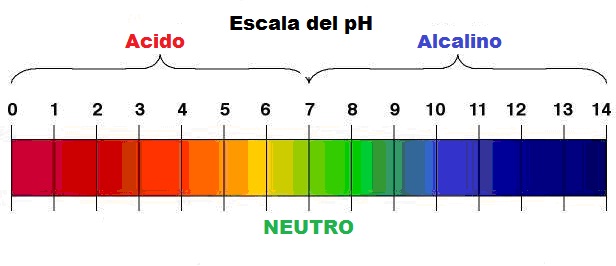
La lectura del valor del pH es pues una medida que indica la concentración de iones de hidrógeno de una solución, indicando el grado de acidez o alcalinidad de la misma, y su rango de lectura va desde 0 (más ácida) hasta 14 (más alcalina) considerando un pH de 7 como NEUTRO.
¿Como medimos el ph de nuestra agua de riego o sustrato?
A continuación os muestro algunas ideas:
Este es un tipo de medidor de pH del suelo económico y fácilmente localizable en muchos viveros y Gardens, que además trae opciones para medir también el grado de humedad y de intensidad lumínica que le llega a la planta.
No es de una gran precisión pero si sirve para darnos una idea global de la situación.

Este otro es el típico phmetro o medidor de pH digital para obtener el pH de un líquido o solución. Los buenos suelen ser caros pero en EBay y otras web de venta online pueden encontrarse modelos simples bastante económicos.
Necesitan ser recalibrados cada cierto tiempo mediante soluciones estándares que venden con ph fijo.

Claro está que si no queréis gastaros dinero en tener más aparatitos, que ya bastantes herramientas manejamos los bonsaistas, una manera simple y económica es el uso del papel de tornasol que utiliza la colorimetría para la medición del ph y son fácilmente conseguidos en tiendas para acuario o de mantenimiento de piscinas.

La importancia del pH radica en que la disponibilidad de los micronutrientes para las plantas puede ser severamente reducida por pH elevados del sustrato y del agua de riego así como precipitar en sustancias tóxicas y metales pesados e incluso dañar seriamente el sistema radicular si es excesivamente bajo.
En la siguiente imagen podeis ver gráficamente los intervalos de mayor absorción de los nutrientes en función del ph

Las recomendaciones de pH del agua de riego y del sustrato dependen del tipo de plantación, pero en general podemos decir que este valor debe estar entre 5,2 y 6,5 (de acido a ligeramente ácido).
Si el pH y la alcalinidad del agua son mayores, requiere un tratamiento con ácido, si el pH es menor, un tratamiento de encalado.
El ENCALADO
Consiste en incorporar al suelo enmiendas o correctores de calcio y magnesio para neutralizar la acidez del mismo, es decir para que el pH alcance un nivel ideal para los cultivos.
Los materiales que se utilizan para encalado son generalmente: Dolomita Cálcica (mezcla de CaCO3 y MgCO3), Cal Hidratada (Ca(HO)2), Carbonato de calcio y Oxido de Calcio (CaO), todo productos que contienen Ca y es por eso el término de encalado, que se utiliza normalmente para expresar cuando una condición agrega Ca al medio y por lo tanto incrementa su pH.
LA ALCALINIDAD
La alcalinidad es la capacidad del agua para neutralizar los ácidos. Es la concentración de álcalis solubles en la solución o los bicarbonatos disueltos en ella, tales como el bicarbonato de calcio (Ca(HCO3)2), de sodio (NaHCO3) y de magnesio (Mg(HCO3)2); los carbonatos, tales como el de calcio (CaCO3) son los álcalis que más contribuyen a la alcalinidad de las aguas de riego. Los hidróxidos disueltos contribuyen muy poco en la mayoría de los casos, de la misma manera que el amonio, boratos, bases orgánicas, fosfatos y silicatos.
CAPACIDAD TAMPON
La capacidad tampón (buffer) se refiere a la habilidad del agua para mantener estable el pH cuando se le añaden ácidos o bases. El pH y la capacidad tampón están entrelazados uno con el otro; aunque uno podría pensar que mezclando el mismo volumen de un ácido y el de un agua neutra se obtiene un pH a mitad de camino entre los dos, esto pocas veces sucede en la práctica. Si el agua tiene suficiente capacidad tampón, ésta capacidad tampón puede absorber y neutralizar el ácido añadido sin apenas modificar el pH. El concepto es que el tampón actúa como una gran esponja. A medida que se añade ácido, la "esponja" absorbe el ácido sin cambiar mucho el pH. Sin embargo, la capacidad de la "esponja" está limitada; una vez que la capacidad tampón se ha gastado, el pH cambia más deprisa a medida que se añaden ácidos.
EI agua dura suele tener una mejor capacidad tampón y poseer una mayor alcalinidad (pH) que el agua blanda
Uno de los materiales que los aficionados solemos utilizar para mantener estable el pH es el carbón activo y el carbón vegetal mezclado en nuestros sustratos, que amen de para otras cosas que aqui no vienen al caso, aumentan la capacidad buffer del sustrato.
CARBONATOS TOTALES
Como los bicarbonatos y carbonatos son los mayores componentes de la alcalinidad del agua, la mayoría de los Laboratorios asumen que los Carbonatos Totales (CT = carbonatos + bicarbonatos o GH en ingles) es igual a la alcalinidad. En la mayoría de los casos esto es una afirmación segura. La mayoría de las agua de riego de nuestra zona, la suma de los bicarbonatos dan más del 90% de la alcalinidad presente.
El término ¨alcalinidad¨ no debe confundirse con ¨alcalino¨, que indica la situación en donde el nivel de pH es superior a 7.
Algunos laboratorios expresan la alcalinidad como proveniente toda de carbonatos, en mg/l ó ppm de carbonato de calcio (CaCO3), o como meq/l de CaCO3.
Un agua de dureza inferior a 60 mg/L de CaCO3 se considera blanda. Si la dureza es superior a 270 mg/ L de CaCO3, el agua se considera dura.
En tiendas de acuariofilia se pueden encontrar tambien kit para medir químicamente los CT o GH del agua

Dureza temporal
Se produce por carbonatos y puede ser eliminada al hervir el agua o por decantación, dejándola durante al menos 48 horas reposar en un recipiente.
Dureza permanente
Esta dureza no puede ser eliminada al hervir el agua ni por decantación, es usualmente causada por la presencia del sulfato de calcio y magnesio y/o cloruros en el agua. Los únicos medios de eliminarla en parte es utilizando sistemas de filtrado por membrana semipermeables (osmosis inversa) o mediante resinas de intercambio iónico (zeolitas) que intercambian iones sodio por los iones calcio y magnesio presentes en el agua, pero que al ceder sodio al agua es poco recomendable para nuestros cultivos.
La ALCALINIDAD entonces establece la capacidad tampón del agua y regula la cantidad de ácido necesario para cambiar su pH.
Por lo tanto, el pH del agua de riego, indica solamente lo relacionado con la solubilidad de los fertilizantes y la estabilidad de algunos pesticidas. El pH de la solución del suelo indica la disponibilidad de los nutrientes para su absorción por los cultivos. El pH del agua no indica su nivel de alcalinidad.
La alcalinidad del agua está determinada por el nivel de bicarbonatos (HCO3) y carbonatos (CO3); los bicarbonatos es el factor más importante en el agua de riego.
Los cultivos regados con agua de alta alcalinidad es lo mismo que aplicar cal en cada riego.
Podemos decir que un buen margen de alcalinidad del agua de riego está entre 60 y 100 ppm de bicarbonatos.
Niveles entre 100 y 200 ppm de bicarbonatos, es probable que incrementen el pH del medio. En este nivel con el agregado de fertilizantes ácidos se alcanza a manejar la situación.
Para mayores valores de alcalinidad es necesario controlar la misma con el agregado de algún ácido.
El pH de la solución nutriente en contacto con las raíces puede afectar el crecimiento vegetal principalmente de dos formas:
- EL pH PUEDE AFECTAR LA DISPONIBILIDAD DE LOS NUTRIENTES.
Para que las raíces puedan absorber los distintos nutrientes, éstos obviamente deben estar disueltos. Valores extremos de pH pueden provocar la precipitación de ciertos nutrientes, los que permanecen así en una forma no asimilable para las plantas.
- EL pH PUEDE AFECTAR AL PROCESO FISIOLÓGICO DE ABSORCIÓN DE LOS NUTRIENTES POR PARTE DE LAS RAÍCES.
Todas las especies vegetales presentan rangos característicos de pH en los que su absorción es idónea. Fuera de este rango, la absorción por las raíces se ve dificultada y si la desviación en los valores de pH es extrema, puede verse deteriorado el sistema radicular o presentarse toxicidades debidas a la excesiva absorción de elementos fitotóxicos.
COMO NEUTRALIZAR LOS BICARBONATOS EN EL AGUA DE RIEGO
El uso de fertilizantes ácidos, es una manera indirecta de neutralizar la alcalinidad del suelo.
La inyección de ácido en el agua de riego es una forma directa de neutralizar las bases presentes. El ácido puede ser inyectado al agua como un fertilizante más, tomando las precauciones correspondientes.
La cantidad de ácido a inyectar dependerá de la cantidad de bases del agua de riego y del tipo de ácido utilizado y su concentración.
Un miliequivalente (me) de ácido neutraliza completamente un me de base. Por ejemplo un agua que contiene 5,2 me de bases por litro, necesitaría 5,2 me de ácido para neutralizar completamente el litro de agua.
Para la mayoría de las situaciones de riego se debe reducir el 80 ó 90% de las bases en el agua o dejar un remanente de 0,5 me/l, debido a que si eliminamos la totalidad de bicarbonatos del agua, se habrá agotado la capacidad tampón de la solución y se estará sobre un pH de 4, y una mínima cantidad más de ácido aportado hará descender el pH de la solución hasta valores tremendamente peligrosos para el sistema radicular del cultivo.
Cuando se dispone de aguas con concentraciones bajas de bicarbonatos (< 1.5 - 2.0 mM), las necesidades de fósforo no pueden ser cubiertas, al menos en su totalidad, mediante el empleo de ácido fosfórico, y se debe recurrir al uso de otras fuentes de fósforo aptas para fertirrigación, esto es, hay que emplear fundamentalmente fosfato monoamónico o fosfato monopotásico.
En la siguiente tabla vemos las propiedades de diferentes ácidos más usados en fertirrigacion:

Si utilizamos agua osmotizada, que tiene una baja capacidad de buffer o tampon, una manera muy natural de acidificar el agua de riego sin riesgo es mediante la adición de ACIDO CITRICO (zumo de limón) que es un acido debil
Para finalizar solo comentaros que el AGUA OSMOTIZADA tiene un ph normalmente NEUTRO (7) pero también, como ya he dicho, una capacidad buffer muy baja por lo que la adición de cualquier ácido hará bajar rápidamente el pH ¡OJO! no os paseis con los ácidos que en el termino medio está la virtud
CONTROL DE LA ALCALINIDAD DEL AGUA DE RIEGO
La mayoría de nuestras aguas de red, la que sale del grifo, e incluso la de muchos pozos, arroyos y fuentes o manantiales naturales son de carácter BASE o alcalinas, contienen bicarbonatos disueltos y por lo tanto agregan nuestros sustratos material calcáreo. El riego con estas aguas puede limitar el buen desarrollo de nuestras plantas, causado por la elevación excesiva del pH del sustrato o del medio. La magnitud del efecto depende del contenido de bicarbonatos en el agua, la cantidad de agua aplicada, la capacidad buffer del suelo y de la sensibilidad de la planta referida.
Para comprender mejor las soluciones a aplicar en fuentes de agua con estos problemas, es necesario entender los conceptos de pH, alcalinidad y capacidad buffer o tampón.
El pH
La palabra pH es la abreviatura de "pondus Hydrogenium". Esto significa literalmente el peso del hidrógeno. El pH es un indicador del número de iones de hidrógeno. Tomó forma cuando se descubrió que el agua estaba formada por protones (H+) e iones hidroxilo (OH-).
La lectura del valor del pH es pues una medida que indica la concentración de iones de hidrógeno de una solución, indicando el grado de acidez o alcalinidad de la misma, y su rango de lectura va desde 0 (más ácida) hasta 14 (más alcalina) considerando un pH de 7 como NEUTRO.

¿Como medimos el ph de nuestra agua de riego o sustrato?
A continuación os muestro algunas ideas:
Este es un tipo de medidor de pH del suelo económico y fácilmente localizable en muchos viveros y Gardens, que además trae opciones para medir también el grado de humedad y de intensidad lumínica que le llega a la planta.
No es de una gran precisión pero si sirve para darnos una idea global de la situación.

Este otro es el típico phmetro o medidor de pH digital para obtener el pH de un líquido o solución. Los buenos suelen ser caros pero en EBay y otras web de venta online pueden encontrarse modelos simples bastante económicos.
Necesitan ser recalibrados cada cierto tiempo mediante soluciones estándares que venden con ph fijo.

Claro está que si no queréis gastaros dinero en tener más aparatitos, que ya bastantes herramientas manejamos los bonsaistas, una manera simple y económica es el uso del papel de tornasol que utiliza la colorimetría para la medición del ph y son fácilmente conseguidos en tiendas para acuario o de mantenimiento de piscinas.

La importancia del pH radica en que la disponibilidad de los micronutrientes para las plantas puede ser severamente reducida por pH elevados del sustrato y del agua de riego así como precipitar en sustancias tóxicas y metales pesados e incluso dañar seriamente el sistema radicular si es excesivamente bajo.
En la siguiente imagen podeis ver gráficamente los intervalos de mayor absorción de los nutrientes en función del ph

Las recomendaciones de pH del agua de riego y del sustrato dependen del tipo de plantación, pero en general podemos decir que este valor debe estar entre 5,2 y 6,5 (de acido a ligeramente ácido).
Si el pH y la alcalinidad del agua son mayores, requiere un tratamiento con ácido, si el pH es menor, un tratamiento de encalado.
El ENCALADO
Consiste en incorporar al suelo enmiendas o correctores de calcio y magnesio para neutralizar la acidez del mismo, es decir para que el pH alcance un nivel ideal para los cultivos.
Los materiales que se utilizan para encalado son generalmente: Dolomita Cálcica (mezcla de CaCO3 y MgCO3), Cal Hidratada (Ca(HO)2), Carbonato de calcio y Oxido de Calcio (CaO), todo productos que contienen Ca y es por eso el término de encalado, que se utiliza normalmente para expresar cuando una condición agrega Ca al medio y por lo tanto incrementa su pH.
LA ALCALINIDAD
La alcalinidad es la capacidad del agua para neutralizar los ácidos. Es la concentración de álcalis solubles en la solución o los bicarbonatos disueltos en ella, tales como el bicarbonato de calcio (Ca(HCO3)2), de sodio (NaHCO3) y de magnesio (Mg(HCO3)2); los carbonatos, tales como el de calcio (CaCO3) son los álcalis que más contribuyen a la alcalinidad de las aguas de riego. Los hidróxidos disueltos contribuyen muy poco en la mayoría de los casos, de la misma manera que el amonio, boratos, bases orgánicas, fosfatos y silicatos.
CAPACIDAD TAMPON
La capacidad tampón (buffer) se refiere a la habilidad del agua para mantener estable el pH cuando se le añaden ácidos o bases. El pH y la capacidad tampón están entrelazados uno con el otro; aunque uno podría pensar que mezclando el mismo volumen de un ácido y el de un agua neutra se obtiene un pH a mitad de camino entre los dos, esto pocas veces sucede en la práctica. Si el agua tiene suficiente capacidad tampón, ésta capacidad tampón puede absorber y neutralizar el ácido añadido sin apenas modificar el pH. El concepto es que el tampón actúa como una gran esponja. A medida que se añade ácido, la "esponja" absorbe el ácido sin cambiar mucho el pH. Sin embargo, la capacidad de la "esponja" está limitada; una vez que la capacidad tampón se ha gastado, el pH cambia más deprisa a medida que se añaden ácidos.
EI agua dura suele tener una mejor capacidad tampón y poseer una mayor alcalinidad (pH) que el agua blanda
Uno de los materiales que los aficionados solemos utilizar para mantener estable el pH es el carbón activo y el carbón vegetal mezclado en nuestros sustratos, que amen de para otras cosas que aqui no vienen al caso, aumentan la capacidad buffer del sustrato.
CARBONATOS TOTALES
Como los bicarbonatos y carbonatos son los mayores componentes de la alcalinidad del agua, la mayoría de los Laboratorios asumen que los Carbonatos Totales (CT = carbonatos + bicarbonatos o GH en ingles) es igual a la alcalinidad. En la mayoría de los casos esto es una afirmación segura. La mayoría de las agua de riego de nuestra zona, la suma de los bicarbonatos dan más del 90% de la alcalinidad presente.
El término ¨alcalinidad¨ no debe confundirse con ¨alcalino¨, que indica la situación en donde el nivel de pH es superior a 7.
Algunos laboratorios expresan la alcalinidad como proveniente toda de carbonatos, en mg/l ó ppm de carbonato de calcio (CaCO3), o como meq/l de CaCO3.
Un agua de dureza inferior a 60 mg/L de CaCO3 se considera blanda. Si la dureza es superior a 270 mg/ L de CaCO3, el agua se considera dura.
En tiendas de acuariofilia se pueden encontrar tambien kit para medir químicamente los CT o GH del agua

Dureza temporal
Se produce por carbonatos y puede ser eliminada al hervir el agua o por decantación, dejándola durante al menos 48 horas reposar en un recipiente.
Dureza permanente
Esta dureza no puede ser eliminada al hervir el agua ni por decantación, es usualmente causada por la presencia del sulfato de calcio y magnesio y/o cloruros en el agua. Los únicos medios de eliminarla en parte es utilizando sistemas de filtrado por membrana semipermeables (osmosis inversa) o mediante resinas de intercambio iónico (zeolitas) que intercambian iones sodio por los iones calcio y magnesio presentes en el agua, pero que al ceder sodio al agua es poco recomendable para nuestros cultivos.
La ALCALINIDAD entonces establece la capacidad tampón del agua y regula la cantidad de ácido necesario para cambiar su pH.
Por lo tanto, el pH del agua de riego, indica solamente lo relacionado con la solubilidad de los fertilizantes y la estabilidad de algunos pesticidas. El pH de la solución del suelo indica la disponibilidad de los nutrientes para su absorción por los cultivos. El pH del agua no indica su nivel de alcalinidad.
La alcalinidad del agua está determinada por el nivel de bicarbonatos (HCO3) y carbonatos (CO3); los bicarbonatos es el factor más importante en el agua de riego.
Los cultivos regados con agua de alta alcalinidad es lo mismo que aplicar cal en cada riego.
Podemos decir que un buen margen de alcalinidad del agua de riego está entre 60 y 100 ppm de bicarbonatos.
Niveles entre 100 y 200 ppm de bicarbonatos, es probable que incrementen el pH del medio. En este nivel con el agregado de fertilizantes ácidos se alcanza a manejar la situación.
Para mayores valores de alcalinidad es necesario controlar la misma con el agregado de algún ácido.
El pH de la solución nutriente en contacto con las raíces puede afectar el crecimiento vegetal principalmente de dos formas:
- EL pH PUEDE AFECTAR LA DISPONIBILIDAD DE LOS NUTRIENTES.
Para que las raíces puedan absorber los distintos nutrientes, éstos obviamente deben estar disueltos. Valores extremos de pH pueden provocar la precipitación de ciertos nutrientes, los que permanecen así en una forma no asimilable para las plantas.
- EL pH PUEDE AFECTAR AL PROCESO FISIOLÓGICO DE ABSORCIÓN DE LOS NUTRIENTES POR PARTE DE LAS RAÍCES.
Todas las especies vegetales presentan rangos característicos de pH en los que su absorción es idónea. Fuera de este rango, la absorción por las raíces se ve dificultada y si la desviación en los valores de pH es extrema, puede verse deteriorado el sistema radicular o presentarse toxicidades debidas a la excesiva absorción de elementos fitotóxicos.
COMO NEUTRALIZAR LOS BICARBONATOS EN EL AGUA DE RIEGO
El uso de fertilizantes ácidos, es una manera indirecta de neutralizar la alcalinidad del suelo.
La inyección de ácido en el agua de riego es una forma directa de neutralizar las bases presentes. El ácido puede ser inyectado al agua como un fertilizante más, tomando las precauciones correspondientes.
La cantidad de ácido a inyectar dependerá de la cantidad de bases del agua de riego y del tipo de ácido utilizado y su concentración.
Un miliequivalente (me) de ácido neutraliza completamente un me de base. Por ejemplo un agua que contiene 5,2 me de bases por litro, necesitaría 5,2 me de ácido para neutralizar completamente el litro de agua.
Para la mayoría de las situaciones de riego se debe reducir el 80 ó 90% de las bases en el agua o dejar un remanente de 0,5 me/l, debido a que si eliminamos la totalidad de bicarbonatos del agua, se habrá agotado la capacidad tampón de la solución y se estará sobre un pH de 4, y una mínima cantidad más de ácido aportado hará descender el pH de la solución hasta valores tremendamente peligrosos para el sistema radicular del cultivo.
Cuando se dispone de aguas con concentraciones bajas de bicarbonatos (< 1.5 - 2.0 mM), las necesidades de fósforo no pueden ser cubiertas, al menos en su totalidad, mediante el empleo de ácido fosfórico, y se debe recurrir al uso de otras fuentes de fósforo aptas para fertirrigación, esto es, hay que emplear fundamentalmente fosfato monoamónico o fosfato monopotásico.
En la siguiente tabla vemos las propiedades de diferentes ácidos más usados en fertirrigacion:

Si utilizamos agua osmotizada, que tiene una baja capacidad de buffer o tampon, una manera muy natural de acidificar el agua de riego sin riesgo es mediante la adición de ACIDO CITRICO (zumo de limón) que es un acido debil
Para finalizar solo comentaros que el AGUA OSMOTIZADA tiene un ph normalmente NEUTRO (7) pero también, como ya he dicho, una capacidad buffer muy baja por lo que la adición de cualquier ácido hará bajar rápidamente el pH ¡OJO! no os paseis con los ácidos que en el termino medio está la virtud

jozelito- pre bonsai II
- Yo escribo : 158
Me votan : 22
Edad : 71
Localización : Vélez-Málaga (Málaga)
Fecha de inscripción : 29/03/2012
 Re: CONTROL DE LA ALCALINIDAD DEL AGUA DE RIEGO
Re: CONTROL DE LA ALCALINIDAD DEL AGUA DE RIEGO
yo suelo ,mezclarla, riego de vez en cuando con agua del grifo que es muy dura, dejandola reposar unos dos dias, otros con agua de osmosis,y asi voy alternandolas,y luego pues como no nuestra agua de lluvia.gracias
jumulu- pre bonsai
- Yo escribo : 89
Me votan : 0
Localización : cieza
Fecha de inscripción : 10/09/2012
 Re: CONTROL DE LA ALCALINIDAD DEL AGUA DE RIEGO
Re: CONTROL DE LA ALCALINIDAD DEL AGUA DE RIEGO
Muchas gracias Jozelito por compartir este artículo con nosotros. Con maestros como tú, da gusto leer cosas sobre bonsais

AnCarl- bonsai nature
- Yo escribo : 1646
Me votan : 48
Edad : 41
Localización : Sevilla
Fecha de inscripción : 28/03/2012
» PH-El agua; el riego, parametros y calidad
» EL RIEGO DEL BONSAI Medidor de acidez de luz/pH, higrómetro de Monitor de Agua de Suelo
» AGUA DE LLUVIA
» riego automatico s.o.s
» EL RIEGO EN EL BONSAI
» EL RIEGO DEL BONSAI Medidor de acidez de luz/pH, higrómetro de Monitor de Agua de Suelo
» AGUA DE LLUVIA
» riego automatico s.o.s
» EL RIEGO EN EL BONSAI
Página 1 de 1.
Permisos de este foro:
No puedes responder a temas en este foro.

